Ο ΕΟΦ έλαβε αίτηση για άδεια κυκλοφορίας του Dexamethasone Taw για τον COVID-19
04 September 2020, 12:35
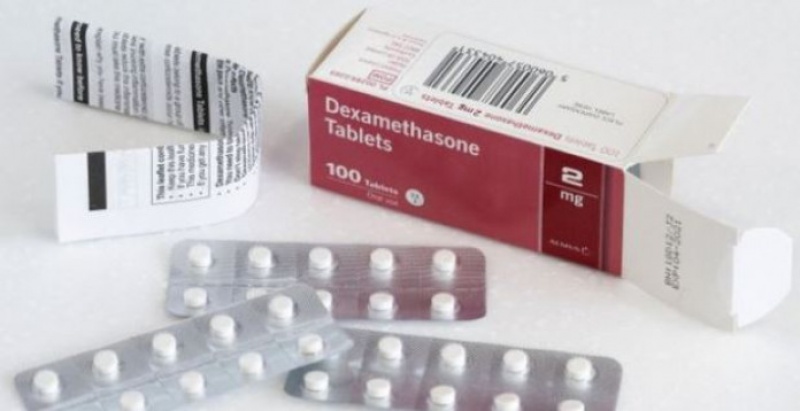
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων έλαβε αίτηση για άδεια κυκλοφορίας του Dexamethasone Taw για τη COVID-19
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (European Medicine Agency, ΕΜΑ) άρχισε να αξιολογεί μια αίτηση για την έγκριση του Dexamethasone Taw για τη θεραπεία ενήλικων ασθενών που νοσηλεύονται με COVID-19. Η αίτηση, από την Taw Pharma, θα αξιολογηθεί από την Επιτροπή για Φάρμακα Ανθρώπινης Χρήσης του EMA (CHMP) σύμφωνα με ένα ταχύτερο χρονοδιάγραμμα αξιολόγησης. Αυτό θα επιτρέψει την έκδοση γνώμης σχετικά με τα οφέλη και τους κινδύνους του Dexamethasone Taw εντός του συντομότερου δυνατού χρονικού πλαισίου.
Τον Ιούλιο του 2020, τα προκαταρτικά αποτελέσματα από τη δοκιμή RECOVERY έδειξαν ότι σε ασθενείς που λάμβαναν νοσοκομειακή θεραπεία για σοβαρές αναπνευστικές επιπλοκές του COVID-19, υπήρχαν λιγότεροι θάνατοι σε όσους από αυτούς έλαβαν δεξαμεθαζόνη. Σε ασθενείς που έλαβαν επεμβατική μηχανική αερισμού, το 29% των ατόμων που έλαβαν θεραπεία με δεξαμεθαζόνη πέθαναν εντός 28 ημερών από την έναρξη της θεραπείας με δεξαμεθαζόνη σε σύγκριση με το 41% των ασθενών που έλαβαν συνήθη φροντίδα, με σχετική μείωση των θανάτων περίπου 35%. Σε ασθενείς που λάμβαναν οξυγόνο χωρίς μηχανικό εξαερισμό, τα ποσοστά ήταν 23% με δεξαμεθαζόνη και 26% με τη συνήθη φροντίδα. Δεν παρατηρήθηκαν μειώσεις στον θάνατο σε ασθενείς που δεν λάμβαναν οξυγονοθεραπεία ή μηχανικό εξαερισμό.
Πριν λάβει αυτήν την αίτηση, η CHMP είχε αρχίσει να εξετάζει τα αποτελέσματα της δοκιμής RECOVERY προκειμένου να παράσχει γνώμη σχετικά με τη χρήση φαρμάκων δεξαμεθαζόνης για την COVID-19. Το αποτέλεσμα αυτής της αναθεώρησης θα εξεταστεί κατά την αξιολόγηση του Dexamethasone Taw.
Εάν τα διαθέσιμα δεδομένα δείξουν ότι τα οφέλη του Dexamethasone Taw υπερτερούν των κινδύνων που συνδέονται με αυτό στη θεραπεία νοσοκομειακών ενηλίκων με COVID-19, ο EMA θα εκδώσει θετική σύσταση για τη νέα χρήση του φαρμάκου σε ασθενείς με COVID-19. Στη συνέχεια, ο Οργανισμός θα επικοινωνήσει με την Ευρωπαϊκή Επιτροπή για να επισπεύσει την αδειοδότηση.
Τα φάρμακα δεξαμεθαζόνης έχουν εγκριθεί για αρκετές δεκαετίες για τη θεραπεία διαφόρων καταστάσεων με βάση τις αντιφλεγμονώδεις ιδιότητες τους. Αυτή η εφαρμογή δεν επηρεάζει τη χρήση άλλων φαρμάκων δεξαμεθαζόνης.
Περισσότερα για το φάρμακο
Η δεξαμεθαζόνη Taw αναπτύσσεται ως υβριδικό φάρμακο. Αυτό σημαίνει ότι είναι παρόμοιο με ένα «φάρμακο αναφοράς» (σε αυτήν την περίπτωση το Fortecortin Inject) που περιέχει την ίδια δραστική ουσία, αλλά διαφέρει από ορισμένες απόψεις, όπως η περιεκτικότητα, η χρήση ή η φαρμακευτική μορφή. Όπως το Fortecortin Inject, το Dexamethasone Taw θα είναι διαθέσιμο ως ενέσιμο φάρμακο και, εάν εγκριθεί, θα χρησιμοποιηθεί για τη θεραπεία των ίδιων παθήσεων με την προσθήκη της COVID-19.
Περισσότερες πληροφορίες για τη διαδικασία
Περαιτέρω πληροφορίες σχετικά με τον τρόπο με τον οποίο ο EMA παρακολουθεί ταχέως τις ρυθμιστικές διαδικασίες, έτσι ώστε οι άδειες κυκλοφορίας ασφαλών, αποτελεσματικών και υψηλής ποιότητας φαρμάκων που σχετίζονται με COVID-19 να μπορούν να χορηγηθούν το συντομότερο δυνατόν, είναι διαθέσιμες στον ιστότοπο του EMA.